
« L’addiction est un processus dans lequel est réalisé un comportement qui peut avoir pour fonction de procurer du plaisir et/ou de soulager un malaise intérieur et qui se caractérise par l’échec répété de son contrôle et sa persistance en dépit de la connaissance de ses conséquences négatives »[1]. La dépendance psychologique, ou addiction (nous emploierons les deux termes), se traduit ainsi par la recherche compulsive du produit ou du comportement (craving), et l’impossibilité de prendre la décision de contrôler ou de stopper la consommation ou le comportement malgré le souhait de le faire.
Décision…à l’insu ou de son plein gré
La décision chez l’individu en bonne santé relève de deux mécanismes complémentaires : un mécanisme planifié, dépendant d’une évaluation préalable des conséquences d’un choix, de son utilité, mécanisme lent mais contrôlé consciemment, déclaratif ; et un mécanisme automatisé, rapide et peu flexible, généralement mis en place à l’issue d’une procédure d’apprentissage , qui consolide des choix comportementaux itératifs, comme jouer du violon, conduire une voiture, manger, -ce qui libère l’attention pour d’autres choix planifiés intercurrents.
Le système planifié déclaratif siège dans le cortex entorhinal, prélimbique, orbitofrontal, le striatum ventral et l’hippocampe.
Le système automatique procédural dépend d’une boucle entre le cortex pariétal, infra-limbique et le striatum dorsal.
Ces deux systèmes reçoivent des afférences dopaminergiques modulatrices issues de l’aire tegmentale ventrale pour le système planifié et de la substance noire pour le système automatique.
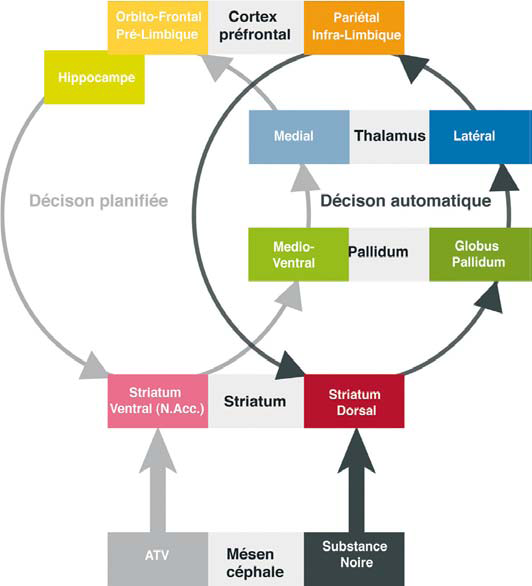
Le système de prise de décision planifiée implique une boucle neuronale striato-pallido-thalamo-corticale, médio-ventrale (gris clair), régulée par les projections dopaminergiques issues de l’aire tegmentale ventrale (ATV). Les projections dopaminergiques de la substance noire modulent une boucle striato-pallidothalamo- corticale (gris foncé) située latéro-dorsalement à la précédente. Cette boucle sous-tend le système de décision planifié. Les résultats récents des neurosciences suggèrent que l’activation excessive de la boucle médio-ventrale renforcerait la connectivité entre les deux sytèmes. Ce processus se traduirait sur le plan comportemental par une implication croissante du système de décision automatique, au détriment du système de prise de décision planifiée.
Décision sous l’influence de la carotte et du bâton
Le système de la récompense est directement impliqué dans ce mécanisme d’apprentissage et de décision. Il trouve son origine dans une petite structure localisée au sommet du tronc cérébral, l’aire tegmentale ventrale (VTA). Cette dernière est directement connectée avec le cortex préfrontal et le noyau accumbens, mais aussi avec l’amygdale et l’hippocampe. La transmission de l’information entre la VTA et ses structures cibles fait intervenir la dopamine.
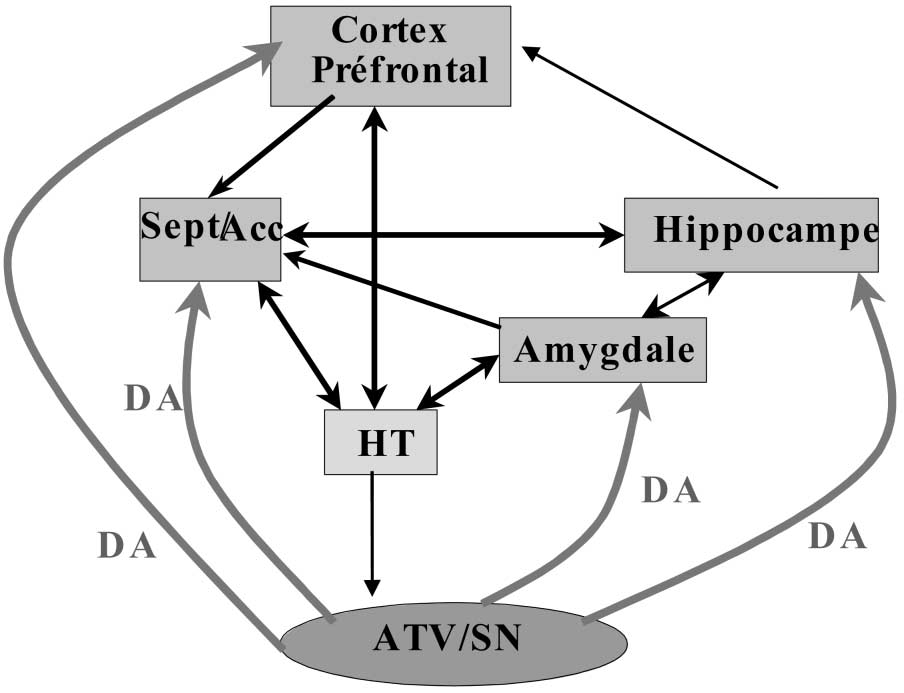
Le circuit cérébral de la récompense Ce circuit peut être considéré comme constitué de plusieurs structures corticales et sous-corticales (en orange) qui sont reliées entre elles par des cellules effectrices . Les neurones dopaminergiques, modulateurs (en rouge), innervent toutes ces structures de façon divergente à partir de l’aire tegmentale ventrale (ATV) et la substance noire (SN). L’ensemble des informations traitées par les neurones du circuit de la récompense converge vers l’hypothalamus (en vert) qui lui-même interagit avec les neurones dopaminergiques du mésencéphale (ATV/SN). Il est à noter qu’aucune information issue de l’environnement extérieur n’atteint l’hypothalamus sans avoir été préalablement traitée par une au moins des structures qui constituent le circuit de la récompense. DA = dopamine, Sep/Acc = septum / noyau accumbens, double flèche = interaction entre système effecteur et système modulateur.
La dopamine intervient donc dans l’apprentissage de comportements orientés vers la recherche de récompense. Elle instruit le système de décision d’une relation entre une situation donnée et l’obtention d’une récompense, d’un plaisir. Les neurones de la VTA codent la différence entre ce qui est attendu et ce qui est obtenu. La récompense est systématiquement comparée avec la prédiction, et la différence constitue ce que l’on appelle « l’erreur de prédiction de la récompense ». Lorsque le lien s’est construit entre le comportement et l’effet recherché, que l’apprentissage est terminé, la stimulation dopaminergique cesse habituellement.

Diana Martinez a montré une relation entre la concentration de récepteurs à dopamine et le statut social : « cette molécule […] met en œuvre des circuits de neurones impliqués dans la motivation », « le statut social est évidemment une source de satisfaction importante puisqu’elle recouvre de multiples plaisirs : pouvoir, argent, relations sexuelles, présence d’un entourage ». « Il semble que les personnes ayant de plus fortes concentrations de récepteurs de la dopamine soient davantage motivées, car elles en retireraient un plaisir intense ».
« À l’inverse, les individus dont le cerveau est pauvre en récepteurs de la dopamine sont plus vulnérables à la consommation de drogues qui stimulent artificiellement les circuits de la dopamine : leurs circuits dopaminergiques sont naturellement trop discrets pour être satisfaits par les réalisations sociales[2] ».
Les stimuli addictifs (substances et comportements) sont perçus comme des récompenses, ce qui renforce leur consommation, mais ils augmentent la sécrétion dopaminergique du striatum ventral, ce qui empêche l’effet d’atténuation normalement observé après la répétition d’un stimulus « récompensant »[3]. Le système de décision planifiée est sans cesse sollicité par la dopamine en direction du stimulus addictif, et le système de décision automatique prend finalement le relais, pour installer une compulsion invincible pour le produit, ou pour le comportement addictif[4].
Apprendre à (ne pas ) prendre de décision (suivie d’effet)
La plasticité synaptique est le mécanisme d’adaptation neuronale qui est à la base de la formation et de la modification des réseaux neuronaux, « c’est le corrélat cellulaire des mécanismes d’apprentissage ». La synapse est la zone de contact entre deux neurones. La libération de neurotransmetteurs par le neurone d’amont permet leur fixation par les récepteurs du neurone d’aval. En jouant sur l’expression des récepteurs ou la quantité de neurotransmetteurs libérés, les neurones renforcent (potentialisation à long terme ou PLT) ou dépriment (dépression à long terme ou DLT) la transmission synaptique.

Dans le cas de l’addiction, une substance addictive ou un comportement associé à un stress déclenche une PLT au niveau des synapses glutamatergiques établies avec les neurones dopaminergiques de l’ATV par augmentation massive de la concentration de dopamine dans la synapse[5]. Le système décisionnel planifié est d’abord sollicité mais rapidement s’opère une transition en faveur du mode automatique[6], sous l’effet de l’activation persistante et soutenue de l’ATV, par recrutement des afférences dopaminergiques projetant vers le cortex infralimbique et le striatum dorsal, centres de la décision automatique[7]. Ce remodelage massif des réseaux d’apprentissage est sous la dépendance de nombreux facteurs physiologiques et l’analyse génétique a déjà montré l’existence de facteurs de vulnérabilité à l’origine des défaillances des systèmes de décision, assimilés à des « synaptopathies »[8].
En conclusion, l’exercice du libre arbitre n’est pas une donnée permanente ni générale de notre psyché. L’expérience du plaisir, de la gratification influence en profondeur nos dispositions à agir, et nos capacités de décision. L’addiction s’apparente aux passions des temps anciens, à une forme d’attachement insurmontable, dont on comprend mieux aujourd’hui les déterminations physiologiques.
1.Balland B , Lüscher C. (2009) Addiction: from learning to compulsion. Psychiatr Sci Hum Neurosci (2009) 7:35-42
2. Belin D, Everitt BJ (2008) Cocaine seeking habits depend upon dopamine-dependent serial connectivity linking the ventral with the dorsal striatum. Neuron 57:432–441
3. Bellone C, Lüscher C (2006) Cocaine triggered AMPA receptor redistribution is reversed in vivo by mGluR-dependent long-term depression. Nat Neurosci 9:636–641
4. Berridge KC, Robinson TE (1998) What is the role of dopamine in reward: hedonic impact, reward learning, or incentive salience? Brain Res Brain Res Rev 28:309–369
5. Carr DB, Kalivas PW (2008) Confused about NMDA and addiction? Targeted knockouts provide answers and new questions. Neuron 59:353–355
6. Engblom D, Bilbao A, Sanchis-Segura C, et al (2008) Glutamate receptors on dopamine neurons control the persistence of cocaine seeking. Neuron 59:497–508
7. Everitt BJ, Belin D, Economidou D, et al (2008) Review. Neural mechanisms underlying the vulnerability to develop compulsive drug-seeking habits and addiction. Philos Trans R Soc Lond B Biol Sci 363:3125–3135
8. Goldman D, Oroszi G, Ducci F (2005) The genetics of addictions: uncovering the genes. Nat Rev Genet 6:521–532