La deuxième loi de la thermodynamique rend la vie possible, et mortelle[1]…
La deuxième loi de la thermodynamique correspond à cette règle simple: spontanément, l’énergie tend à se disperser, si rien n’y fait obstacle. Les glaçons fondent dans le verre quand il fait chaud sur la plage, les fruits tombent des arbres, un pneu crevé se dégonfle…

L’univers tel que nous le connaissons est dirigé par les lois de la dynamique chimique autant que par celles de la thermodynamique[2]. Dans le monde chimique, la deuxième loi de la thermodynamique est contrée par la force des liens chimiques entre atomes et molécules. La tendance à la dispersion n’est jamais éliminée, mais dans de nombreux composés, elle est bloquée pour la durée de leur existence et même davantage.
Les atomes et les molécules s’attirent intrinsèquement. Les atomes interagissent et forment des liaisons qui résistent à des températures très élevées (voir les métaux). Les molécules formées de plusieurs atomes sont elles aussi précisément organisées selon un ordre géométrique stable dans le temps.
Quand l’hydrogène et l’oxygène réagissent ensemble, la réaction produit une dépense d’énergie élevée sous forme de chaleur et d’eau, qui est d’un niveau énergétique moindre, mais d’une structure plus complexe que les éléments dont elle est formée, et ses atomes sont diposés selon un schéma géométrique fixe.
Il y a des millions de composés qui contiennent moins d’énergie que les éléments dont ils sont composés. Cela signifie que la seconde loi favorise intrinsèquement la formation de molécules complexes, géométriquement ordonnées à partir de simples atomes[3]. La seconde loi favorise des unités ordonnées, précisément arrangées plutôt que les unités simples.

Les éléments chimiques qui contiennent une certaine quantité d’énergie tendent à former des substances à plus bas niveau d’énergie, et l’énergie différentielle au cours de la réaction est dispersée dans l’univers sous forme de chaleur, qui correspond à notre mesure de la quantité de mouvement dans les atomes et les molécules.
De même, chacune des 30000 substances qui composent notre corps suit les lois de formation de la deuxième loi en étant élaborées à partir d’éléments plus simples. Ces substances contiennent moins d’énergie que les éléments dont ils sont formés. La seconde loi ne prédit pas la disparition des structures ordonnées, seulement la dispersion d’énergie dans tout processus.
La matière vivante évolue énergétiquement, du niveau de plus haute énergie des éléments simples, vers un niveau moins élevé, qui est celui des composés biochimiques organiques, et quand ceux qui entrent en réaction avec l’oxygène et produisent de l’eau et du gaz carbonique, les composés oxydés résiduels présentent un niveau d’énergie encore inférieur au précédent. Le vivant produit donc des composés plus stables car de niveau énergétique inférieur, mais l’oxydation a finalement raison de cette méta-stabilité, et aboutit à des composés oxydés dysfonctionnels, à la maladie et à la mort.
Notre organisme utilise le flux d’énergie rendu disponible par l’application de la deuxième loi aux aliments qui subissent l’oxydation lors de la digestion puis de la respiration cellulaire. Ce flux permet la synthèse de tous nos composés complexes, rend possible toute activité, biochimique, musculaire ou mentale et produit la chaleur nécessaire au fonctionnement de tous ces composés chimiques.
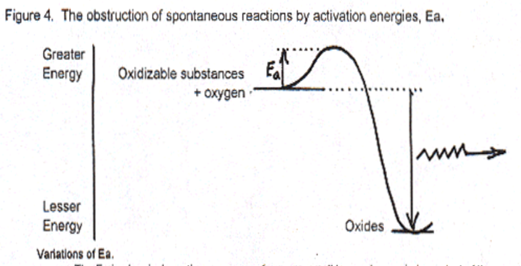
Des substances de plus haute énergie peuvent être produites si de l’énergie externe est apportée. Mais toute substance tend vers un niveau de moindre énergie. Tout substance à haut niveau d’énergie persiste dans le temps grâce à l’énergie d’activation qui empêche cette évolution vers des composés de moindre énergie.
L’énergie d’activation protège les molécules de haut niveau énergétique vis à vis de la tendance à la dispersion
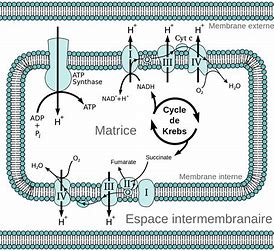
La deuxième loi de la thermodynamique est entravée par l’énergie d’activation, c’est à dire la quantité d’énergie supplémentaire nécessaire pour initier une réaction dans un produit chimique. La flamme d’une allumette est nécessaire pour faire réagir la feuille de papier avec l’oxygène de l’air, ou incendier la forêt. L’énergie d’activation correspond à la quantité d’énergie qui doit être apportée pour déclencher une réaction d’oxydation dans un matériau quelconque, en brisant les liens chimiques qui préviennent cette réaction. La flèche du temps de la seconde loi de la thermodynamique ne peut être réalisée sans l’apport de cette énergie d’activation. Quand elle est fournie, les réactions se produisent spontanément pour toute matière en présence d’oxygène, avec une importante dispersion d’énergie dans l’univers. Les composés chimiques complexes sont protégés de la dispersion vers des niveaux d’énergie plus bas par l’énergie d’activation. Aucune vie ne serait possible sur terre sans l’énergie d’activation[4], car nos corps prendraient feu spontanément en réagissant avec l’oxygène.
La nature utilise un processus mixte, spontané et non spontané pour produire des substances composées d’une plus grande quantité d’énergie que les élements dont elles sont issues. L’énergie solaire (processus spontané de la deuxième loi), couplée à des mécanismes chimiques complexes transforme du dioxyde de carbone, de l’eau et des traces de minéraux en composés complexes organisés pour résister à la deuxième loi grâce à leur énergie d’activation. On ne construit des substances de plus haute énergie, qu’en utilisant de l’énergie disponible grâce à la deuxième loi de la thermodynamique, indispensable pour la fabrication des substances de plus haute énergie (le minerai de fer transformé en acier, l’énergie des aliments transformée en ATP). Une partie de l’énergie utilisée sera nécessairement dispersée et convertie en chaleur.
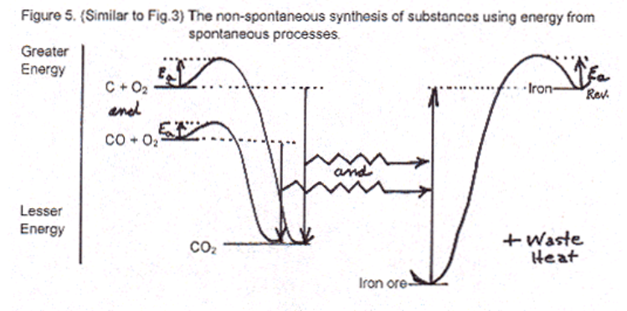
C’est l’énergie produite par l’oxydation qui produit de la chaleur à notre corps et permet la synthèse de 30000 composés différents, protéines, hormones, hémoglobine…. Le transfert d’énergie depuis une oxydation spontanée (catabolisme) vers une synthèse non spontanée (anabolisme) est essentiel. C’est le couplage énergétique, caractéristique du vivant.

La vie est en même temps menacée par la seconde loi de la thermodynamique: tous les composés organiques chimiques synthétisés à partir de réactions non spontanées sont métastables. C’est l’énergie d’activation qui les protège d’une oxydation instantanée à l’air libre. La vie ne survit que grâce à une multitude de machines moléculaires qui utilisent de l’énergie pour s’opposer à la deuxième loi. Les énergies d’activation et boucles chimiques rétroactives agissent en protecteurs vis à vis de la 2ème loi de la thermodynamique. Les systèmes biochimiques nous protègent généralement contre les attaques bactériennes et les dysfonctionnements de tous ordres. Ces systèmes de régulations rétroactives sont exposés au risque d’insuffisance en fourniture énergétique, à des dysfonctionnements issus d’erreurs critiques de synthèse, à la présence de toxines, de bactéries ou de virus. Le dysfonctionnement qui en résulte aboutit in fine à la maladie et à la mort.
L’entropie mesure l’effet que cela fait à un système de perdre son énergie
L’entropie est une mesure de la dispersion d’énergie: quelle quantité d’énergie est-elle émise lors d’un processus donné, à une température donnée? Par exemple, les molécules d’air chaud en été abandonnent une partie de leur énergie aux glaçons de la boisson rafraîchissante, ce qui brise des liaisons entre molécules d’hydrogène dans les molécules d’eau des glaçons. Celles-ci retrouvent avec l’état liquide une quantité de mouvement supérieure à celle des blocs de glace.
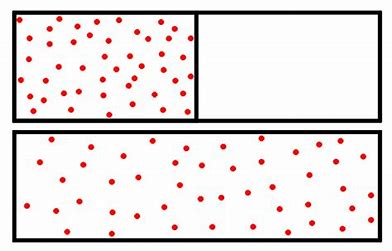
sa mesure correspond à l’entropie
De même, un gaz se déplace dans un espace vide, car toute molécule chargée d’énergie de mouvement (translationnel ou rotatoire) se disperse autant que possible, en l’absence d’entrave. L’extension de la dispersion d’énergie, correspond à l’augmentation de l’entropie. La mesure de cette entropie n’est pas triviale, car il n’y a pas de modification d’énergie dans le gaz qui se répand. A la différence de l’eau qui peut être recongelée, le processus de dispersion du gaz est irréversible, et la mesure d’entropie porte, non pas sur la dispersion d’énergie, mais sur l’extension du gaz dans un volume d’air supérieur au volume initial (du pneu vers l’atelier de réparation)?

Des gaz ou des liquides déposés successivement dans un bocal tendent à se mélanger simplement du fait de l’énergie de mouvement des molécules qui se déplacent et entrent en collision. L’entropie n’est pas la mesure du chaos, ni du désordre, mais ne concerne que l’énergie, sa dispersion et la température à laquelle advient cette dispersion. En mesurant l’entropie, on mesure la différence dans la distribution d’énergie entre avant et après un événement.
L’entropie change en chimie sous l’effet soit d’un processus réversible de dispersion d’énergie de mouvement moléculaire, rapporté à la température absolue ou d’un processus d’expansion moléculaire dans un volume (sans changement de température).
L’entropie mesure l’importance pour un système donné de la dispersion d’énergie dans ce système à une température donnée. Le changement d’énergie va toujours du chaud vers le froid, du plus haut niveau d’énergie vers le plus bas. L’augmentation de l’entropie prédit des événements chimiques spontanés, et est nommée pour cela la flèche du temps. L’énergie se disperse continuellement dans tous les événements naturels.

Une augmentation de l’entropie à l’échelle moléculaire correspond à l’augmentation de mouvement de chaque molécule, et l’augmentation du nombre d’états instantanés différents que peut prendre l’ensemble des molécules à chaque instant. Le changement de disposition des molécules les unes vis à vis des autres est équivalent à la dispersion dans l’espace ou à la dispersion thermique (du plus chaud vers le moins chaud). Plus de choix pour les états instantanés est équivalent à l’énergie plus dispersée et une entropie supérieure.
L’énergie de mouvement des molécules de chaque composant dans une solution est plus élevée que dans un état pur, car c’est la séparation d’une molécule des autres molécules de sa catégorie qui augmente l’entropie de la mixture[5].
En conclusion la deuxième loi de la thermodynamique présente des opportunités et des limites
Les flux d’énergie de toutes sortes sont la force qui conduit les objets du monde vers le désordre, la maladie, la mort[6]. Cette force peut briser les liaisons chimiques et permettre la dispersion des particules résultantes. Mais cette même force favorise aussi la production de substances chimiques plus complexes, de niveau énergétique inférieur, qui interviennent pour limiter la dispersion d’énergie au sein d’un système organique, et prolonger son existence dans le temps. La deuxième loi de la thermodynamique favorise la complexité du vivant qui l’utilise pour se fournir en énergie, et qui s’organise pour retarder lui-même la dispersion énergétique qui s’opère in fine sur ses composants à cause de l’énergie d’activation fournie par les composés pro-oxydants de l’univers.
Pour en savoir plus, notre ouvrage sur l’avenir du vieillissement: “Vieillir, un destin remédiable“.

[1] Entropy and the second law of thermodynamics (oxy.edu) Lambert FL. Entropy and the second law of thermodynamics. 2007.
[2] Keith J. Laidler “To Light Such A Candle” (Oxford, 1998)
[3] Obstructions to the second law make life possible – – – (oxy.edu)
[4] Obstructions to the second law make life possible – – – (oxy.edu)
[5] J. Chem. Educ. 2007, 84, 9, 1548 Publication Date:September 1, 2007 https://doi.org/10.1021/ed084p1548