
Les sénolytiques que nous allons passer en revue sont des substances dérivées des plantes qui présentent des propriétés utilisées dans la médecine du vieillissement. Comment les sénolytiques remédient-ils aux processus biologiques qui contribuent au vieillissement et conduisent progressivement l’organisme vers des pathologies chroniques, diabète, maladies neuro-dégénératives, et cardio-vasculaires? L’inflammation de bas niveau, les changements moléculaires des protéines, des lipides, des mitochondries et de l’ADN, les dysfonctions des cellules souches et la sénescence cellulaire sont des phénomènes liés entre eux qui participent du vieillissement de l’organisme. Cette interdépendance est manifestée par le fait qu’une intervention qui cible un de ces processus atténue les autres[1]. Le dysfonctionnement qui s’établit progressivement dans les cellules peut être corrigé, pour une vie plus longue, en meilleure santé.
Moins de défenses vis à vis des espèces réactives de l’oxygène
Les espèces réactives de l’oxygène (ERO) sont impliquées dans tous les mécanismes du vieillissement. Il y a une corrélation forte entre l’âge biologique, le niveau de production d’espèces réactives de l’oxygène (ERO) et l’atteinte des tissus par l’oxydation. Les mitochondries sont de grands producteurs d’ERO. Celles-ci altèrent les protéines de l’ADN, et conduisent à la sénescence cellulaire, aux altérations fonctionnelles et aux pathologies qui en découlent[2].
Au niveau mitochondrial, l’anion superoxyde O2-, produit par les mitochondries est converti en peroxyde d’hydrogène par l’enzyme super oxyde dismutase 1 (SOD1) dans le cytosol et la SOD2 dans la mitochondrie. Celui-ci est transformé en eau et oxygène par la catalase et les glutathion peroxydases[3]. Malheureusement, tandis que la production d’ERO augmente avec l’âge, celle de glutathion peroxydase décroît[4]. Nous verrons plus loin que les substances phytochimiques jouent un rôle significatif dans l’équilibre entre ERO et antioxydants, par le biais de plusieurs mécanismes.
De multiples voies métaboliques perdent en efficacité
L’AMPK est une molécule majeure de la régulation de l’énergie dans l’organisme. Elle coordonne les réponses au stress, le contrôle hormonal de la prise de nourriture, et de la dépense énergétique. Elle inhibe la néoglucogenèse hépatique[5], promeut l’oxydation des acides gras, améliore la sensibilité à l’insuline et régule la synthèse de mitochondries[6]. L’activation de l’AMPK augmente la durée de vie et retarde le vieillissement dans plusieurs espèces[7]. A l’inverse, une diminution de l’activité de l’AMPK s’accompagne d’un dysfonctionnement musculaire, vasculaire et hépatique[8].
Les sirtuines sont des enzymes conservées par l’évolution depuis les bactéries. La restriction calorique semble augmenter la durée de vie des organismes en stimulant les sirtuines[9]. Certaines substances phytochimiques reproduisent l’effet de la restriction calorique, et produisent ainsi leur effet sénolytique.
L’axe GH/IGF-1 contribue à la régulation du processus anti-âge. Il interagit avec SIRT1, AMPK et mTOR. La curcumine, le resvératrol et l’épigallocatéchine inhibent l’axe IGF-1.
L’autophagie est un ancien mécanisme d’adaptation à la privation de nourriture, chez les cellules eucaryotes, par consomption des protéines du lysosome. L’autophagie permet de fournir en énergie une cellule privée de ressources, en recyclant des protéines et des mitochondries au fonctionnement altéré. Par là, l’autophagie est un mécanisme essentiel de l’équilibre cellulaire[10]. Le déclin de l’autophagie avec l’âge conduit à la production de davantage d’ERO, au vieillissement de l’organisme avec son cortège de maladies.
Les sénolytiques peuvent-ils réduire l’inflammation chronique?
L’inflammation chronique de bas niveau découle notamment de la baisse de fonction de l’autophagie. Elle aggrave le processus du vieillissement et les pathologies qui y sont associées. Les marqueurs IL-6, CRP et TNF-α augmentent avec l’âge en l’absence de toute cause aigüe[11], du fait de taux élevés d’ERO. La restriction calorique atténue ce phénomène.

Deux biomarqueurs de l’inflammation, l’interleukine-6 (IL-6) et la protéine C-reactive (CRP) permettent d’évaluer l’inflammation chronique de bas niveau (LGI)[12]. Leur élévation est associée à celle de facteurs de transcription pro-inflammatoires, comme le facteur nucléaire Kappa B (NF-kB)[13].Les inhibiteurs de NF-kB dimimuent les taux d’IL-6 et CRP, et pourraient ralentir le déclin fonctionnel lié à l’âge.
Les inhibiteurs de l’angiotensine II (ARBs), la metformine, les omega-3, les probiotiques, le resvératrol et la vitamine D ont été testés dans une méta-analyse concernant leur impact sur l’inflammation chronique[14]. Cette revue de littérature de 2018 a porté sur les études contrôlées et randomisées (RCTs) afin d’évaluer les effets de ces substances sur l’inflammation chronique. En comparaison avec un placebo, les inhibiteurs d’angiotensine II, les omega-3 et les probiotiques réduisent significativement le niveau de CRP et d’IL-6 (incluant la metformine pour IL-6) et confirment un effet sénolytique. En revanche, ni le resvératrol ni la vitamine D n’ont montré d’effet sur CRP et IL-6.
Les sartans sont des médicaments anti-hypertenseurs d’usage sûr, provoquant peu d’effets indésirables chez les patients normotendus. Ils procurent une réduction faible à modérée des taux d’IL-6 et CRP[15]. Cet effet est obtenu en bloquant le récepteur de de l’angiotensine II, ce qui inhibe le NF-kB.
La metformine est l’hypoglycémiant le plus prescrit depuis 60 ans, d’usage sûr. En parallèle de cet effet hypoglycémiant, elle augmente la longévité par ses effets anti-inflammatoires et anti-apoptotiques, par l’inhibition de la transcription du facteur NF-kB. Elle obtient une réduction modeste mais significative du niveau sanguin de CRP.
Les omega-3 obtiennent une réduction faible mais significative de CRP et d’IL-6, proportionnelle à la durée du traitement. Les probiotiques rééquilibrent le microbiote âgé, qui favorise une flore de putréfaction au détriment de la flore de fermentation. Ils modulent la réponse immunitaire en inhibant la voie du NF-kB. L’effet est modéré voire élevé, notamment en relation avec la durée du traitement, qui module la portée sénolytique.
La sénescence, ou quand la cellule dysfonctionnelle refuse de s’effacer
Les cellules sénescentes résistent à l’apoptose du fait de la surexpression des voies anti-apoptotiques des cellules senescentes (SCAPs)[16]. La quercétine et le dasatinib permettent d’obtenir l’apoptose de certaines cellules sénescentes, mais pas toutes[17], après un traitement de seulement trois jours. Ce traitement permet d’améliorer la réactivité vasculaire, la fraction d’éjection cardiaque, la fonction pulmonaire, la stéatose hépatique, l’ostéoporose, chez des cellules âgées[18]. Elle réduit la perte de glucosaminoglycanes du disque intervertébral. Ces composés sénolytiques ont un effet significatif sur les pathologies dégénératives liées à l’âge. Mais les cellules sénescentes expriment différents types de marqueurs de sénescence et utilisent différentes voies de résistance à l’apoptose.
Les plantes produisent des sénolytiques qui prolongent le bon fonctionnement cellulaire
Certaines molécules que l’on trouve dans l’alimentation ont des propriétés anti-âge, dites sénolytiques (resvératrol, extrait de thé vert, épicatéchine, quercétine et curcumine). Leur consommation quotidienne peut améliorer la santé et prolonger l’espérance de vie dans de nombreux modèles animaux, par différents mécanismes (réduction du stress oxydatif, suppression de l’inflammation de bas grade, induction de l’autophagie, amélioration de la fonction mitochondriale).
Ces substances phytochimiques sénolytiques sont des métabolites issus des plantes, que l’on trouve dans les végétaux, les fruits, les céréales, les noix, et dans des boissons comme le vin, le thé et le café. Nous ingérons environ 1g par jour d’agents phytochimiques avec l’alimentation[19]. Les principales catégories d’agents phytochimiques sont des dérivés phénoliques, des terpènes, des betalaïnes, des organosulfites, des dérivés indoles, des glucosinolates, des inhibiteurs protéiques et d’autres acides organiques[20].
Les substances phytochimiques peuvent directement éliminer les ERO[21]
De nombreux phytochimiques sont des antioxydants qui permettent d’éliminer les ERO, grâce à leurs groupes hydroxyles phénoliques[22].Plus ces fonctions hydroxyles sont nombreuses, plus puissante est leur capacité antioxydante, et sénolytique.
Les phytochimiques sénolytiques stimulent la production d’antioxydants
La synthèse de GSH diminue avec l’âge[23], ainsi que celle de SOD, et la baisse de SOD est associée à une réduction de l’espérance de vie chez l’animal. A l’inverse, l’épicatéchine augmente l’espérance de vie en augmentant l’activité de la SOD[24]. D’autres phytochimiques, comme la curcumine[25], le resvératrol[26], et la quercétine[27], augmentent l’activité de la SOD chez la drosophile. Le maintien d’une bonne capacité antioxydante par les phytochimiques est une conséquence de leurs effets anti-âge.
Les phytochimiques sénolytiques régulent la voie du Nrf2, un facteur transcriptionnel qui joue un rôle important dans la détoxification cellulaire. Ce facteur induit l’expression d’enzymes de détoxification, comme la SOD[28]. Là encore, curcumine, resvératrol, sulphorafane, lutéoline, épicatéchine, augmentent l’expression de la protéine Nrf2[29].
De nombreux phytochimiques activent l’AMPK, comme le resvératrol, la quercétine, la curcumine, l’épicatéchine. Le resvératrol, la curcumine, la quercétine et l’épicatéchine réduisent les marqueurs de l’inflammation, et diminuent l’adhésion des monocytes aux autres cellules en inhibant le facteur nucléaire (NF)-kappa, le régulateur principal de la transcription de plusieurs molécules pro-inflammatoires. Par ailleurs, la quercétine, la curcumine, l’épicatéchine et le resvératrol stimulent l’autophagie en bloquant l’activité de mTOR.
Le vin, cure de jouvence grâce au resvératrol?
Le resvératrol est un polyphénol qu’on trouve dans le raisin, le vin, les cacahuètes, le cacao et diverses baies. Un intérêt pour cette molécule s’est développé à partir de l’observation du paradoxe français, à savoir la constatation que les consommateurs français de nourriture riche en acides gras saturés et buveurs de vin présentaient une espérance de vie plus élevée que la moyenne malgré l’exposition aux acides gras saturés, connus pour être corrélés à un risque accru de maladie cardio-vasculaire. Depuis lors, le resvératrol s’est montré utile dans la prévention du diabète, du cancer et de la maladie d’Alzheimer[30]. Le resvératrol est un sénolytique confirmé qui prévient le développement des marqueurs d’Alzheimer et augmente l’espérance de vie des souris en activant la voie de l’AMPK et de SIRT1[31].

Des études ont confirmé que le resvératrol reproduisait les effets de la restricion calorique et pouvait augmenter l’espérance de vie de levures et d’animaux[32]. La consommation de resvératrol diminue la résistance à l’insuline, le stress oxydatif, l’inflammation, la dysfonction vasculaire, l’ostéoporose, la cataracte, et le déclin de la coordination motrice chez la souris âgée au régime riche en acides gras saturés[33].
Le resvératrol active la SIRT1, ce qui augmente la synthèse mitochondriale, le métabolisme énergétique, la sensibilité à l’insuline et la survie de souris à la diète grasse[34]. La médiation de l’AMPK et de SIRT1 semblent impliquées dans ces phénomènes.
L’épicatéchine, l’arme secrète du chocolat

L’épicatéchine est un sénolytique de la famille des flavanol que l’on trouve dans les pommes, les poires, le thé, le raisin et le cacao, principalement. La consommation quotidienne de cacao ou de chocolat améliore la fonction vasculaire, la sensibilité à l’insuline, la pression artérielle, et l’inflammation[35]. L’épicatéchine pourrait contribuer à cette action en augmentant le taux plasmatique d’oxyde nitrique, un puissant vasodilatateur[36]. Par ailleurs, l’épicatéchine améliore l’espérance de vie chez l’animal, et réduit les marqueurs de l’inflammation, augmente le taux hépatique de glutathion, et de l’AMPKα[37]; ces biomarqueurs sont associés à une espérance de vie en bonne santé améliorée.
L’extrait de thé vert et l’épigallocatéchine (EGCG) améliorent l’espérance de vie chez l’animal[38], et peut-être la femme[39].
La quercétine, l’anti-oxydant de choc
La quercétine est un flavonoïde sénolytique que l’on trouve dans le raisin, les baies, les cerises, les oignons, la peau des pommes (d’où l’importance des les choisir BIO), le brocoli. La quercétine active le protéasome des fibroblastes et rajeunit les cellules sénescentes. C’est l’anti-oxydant le plus puissant de la famille des flavonoïdes. Elle exerce une action anti-inflammatoire puissante en inhibant la production de cytokines IL1α, et TNFα dans les cellules immunitaires.
La curcumine, l’amie des articulations
La curcumine est un composé phénolique présent dans la racine de curcuma longa, utilisée dans la médecine traditionnelle indienne et chinoise pour des indications digestives, articulaires et infectieuses notamment. Elle augmente l’espérance de vie chez l’animal[40]. Ses propriétés anti-inflammatoires et anti-oxydantes peuvent contribuer à un effet sénolytique[41].
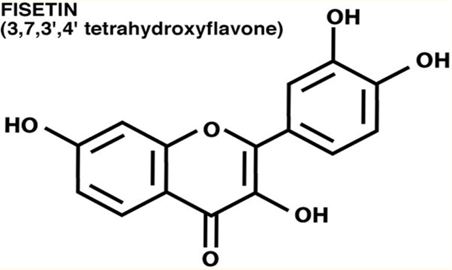
Quand la fisétine apparaît, les cellules sénescentes disparaissent
La fisétine est un flavonoïde présent dans de nombreux fruits et légumes, comme la pomme, le raisin, les oignons, les concombres à très faible dose, les fraises à la dose de 160microg/g[42]. Aucun effet indésirable n’a été reporté à ce jour même à hautes doses[43]. La consommation quotidienne moyenne au Japon est de 0,4mg/j[44]. Elle est très proche chimiquement de la quercétine, n’en diffère que par un groupe hydroxyle en position 5.

La fisétine a été identifiée avec la quercétine par screening, comme une substance capable de préserver le niveau de GSH en présence de stress oxydatif dans le neurone. La fisétine est également neurotrophique.
la fisétine est plus efficace que la quercétine, la curcumine et la lutéoline dans la réduction des marqueurs cellulaires de sénescence in vitro[45]. La fisétine réduit le stress oxydatif hépatique et augmente le taux intracellulaire de glutathion in vivo.
Des souris supplémentées avec fisétine à un âge équivalent à 75 ans chez l’homme ont montré une augmentation de leur durée de vie moyenne et maximale.
La fisétine cible de multiples, mais pas tous les types de cellules sénescentes. Elle réduit également l’expression des marqueurs de sénescence dans de nombreux organes. La fisétine réduit le nombre de cellules T et NK killers, ce qui amplifie son effet sénolytique par son effet sur l’immunité. Elle réduit les marqueurs de l’inflammation et du stress oxydatif, en supprimant les celules sénescentes plutôt qu’en agissant de manière durable sur des récepteurs ou des enzymes[46]. La fisétine augmente l’activité de SIRT1 in vitro. Elle inhibe in vitro l’activité de cytokines pro-inflammatoires, TNFalpha, IL-6, NF-kB[47].
La fisétine améliore les performances cognitives de souris atteintes d’Alzheimer, réduit l’infarctus cérébral et ses conséquences cognitives, améliore la résistance au découragement chez la souris, qui est le modèle d’étude de la dépression chez l’animal. La fisétine semble réguler le métabolisme de la sérotonine par inhibition de la monoamine oxydase A, et celui de la noradrénaline. La fisétine réduit les symptômes anxieux chez la souris diabétique, et améliore la vitesse de conduction nerveuse.
Mécanismes d’actions sénolytiques de la fisétine
Action anti-oxydante
La fisétine est un chélateur du fer dont l’accumulation dans le cerveau âgé est proportionnelle à la perte des performances mnésiques.
La GSH diminue de 30% chez les sujets âgés[48], sous l’effet de la diminution de Nrf2 et ATF4, facteurs limitants de sa synthèse. Ceux-ci diminuent avec le temps, mais la fisétine augmente leur taux, de manière dose dépendante, en doublant la durée de leur demi-vie[49].
Facteur neurotrophique
La fisétine active une voie métabolique neuroprotective (ERK) qui diminue avec l’âge et dans les maladies neurologiques.
Modulation de la réponse immunitaire innée
La microglie est constituée de macrophages cérébraux. Une partie d’entre eux produit des facteurs pro-inflammatoires et cytotoxiques, des cytokines, des radicaux libres, qui conduisent à une neurodégénération. La fisétine réduit l’activité de cette microglie pro-inflammatoire, via différentes voies métaboliques. L’action anti-inflammatoire de la fisétine a été observée in vivo chez des souris atteintes d’Alzheimer. Elle agit sur la microglie et les astrocytes, dans différentes situations impliquant une dysrégulation du système immunitaire dans le cerveau. Elle se présente comme un sénolytique majeur, et fait l’objet de nombreux travaux pour confirmer son innocuité.
Modulation de l’agrégation protéique
La fisétine augmente l’activité du protéasome, ce qui pourrait contribuer à ses effets neuroprotecteurs[50].
Conclusion sur les sénolytiques d’origine végétale
La santé tend à se dégrader au cours du temps, sous l’effet d’une altération progressive du fonctionnement cellulaire, submergé par les espèces réactives de l’oxygène, tandis que ses capacités de défense s’amenuisent. Soutenir et prolonger la santé d’un organisme dans le temps dépend de multiples facteurs sur lesquels on peut agir, notamment nutritionnels et comportementaux. La découverte concomitante des mécanismes d’altération cellulaire et des solutions biochimiques développées par les plantes pour y remédier ouvre la perspective d’une médecine orientée vers le maintien et l’optimisation des fonctions physiologiques humaines.
Pour en savoir plus, notre ouvrage sur l’avenir du vieillissement: “Vieillir, un destin remédiable“.

[1] Kirkland J.L. Translating the science of aging into therapeutic Interventions. Cold Spring Harb Perspect Med. 2016;6(3)
[2] Mitochondrial DNA mutations as an important contributor to ageing and degenerative diseases.Linnane AW, Marzuki S, Ozawa T, Tanaka M Lancet. 1989 Mar 25; 1(8639):642-5.
[3] Mitochondria, oxidants, and aging. Balaban RS, Nemoto S, Finkel T Cell. 2005 Feb 25; 120(4):483-95.
[4] Ratio of reduced to oxidized glutathione as indicator of oxidative stress status and DNA damage. Asensi M, Sastre J, Pallardo FV, Lloret A, Lehner M, Garcia-de-la Asuncion J, Viña J Methods Enzymol. 1999; 299():267-76.
[5] AMPK in Health and Disease. Steinberg GR, Kemp BE Physiol Rev. 2009 Jul; 89(3):1025-78.
[6] Effects of alpha-AMPK knockout on exercise-induced gene activation in mouse skeletal muscle. Jørgensen SB, Wojtaszewski JF, Viollet B, Andreelli F, Birk JB, Hellsten Y, Schjerling P, Vaulont S, Neufer PD, Richter EA, Pilegaard H FASEB J. 2005 Jul; 19(9):1146-8.
[7] AMP-activated protein kinase and FoxO transcription factors in dietary restriction-induced longevity. Greer EL, Banko MR, Brunet A Ann N Y Acad Sci. 2009 Jul; 1170():688-92.
[8] Reduction of AMP-activated protein kinase alpha2 increases endoplasmic reticulum stress and atherosclerosis in vivo. Dong Y, Zhang M, Liang B, Xie Z, Zhao Z, Asfa S, Choi HC, Zou MH Circulation. 2010 Feb 16; 121(6):792-803.
[9] Calorie restriction promotes mammalian cell survival by inducing the SIRT1 deacetylase. Cohen HY, Miller C, Bitterman KJ, Wall NR, Hekking B, Kessler B, Howitz KT, Gorospe M, de Cabo R, Sinclair DA Science. 2004 Jul 16; 305(5682):390-2.
[10] Autophagy and aging: keeping that old broom working. Cuervo AM Trends Genet. 2008 Dec; 24(12):604-12.
[11] The origins of age-related proinflammatory state. Ferrucci L, Corsi A, Lauretani F, Bandinelli S, Bartali B, Taub DD, Guralnik JM, Longo DL Blood. 2005 Mar 15; 105(6):2294-9.
[12] Proinflammatory cytokines, aging, and age-related diseases. Michaud M, Balardy L, Moulis G, Gaudin C, Peyrot C, Vellas B, Cesari M, Nourhashemi F J Am Med Dir Assoc. 2013 Dec; 14(12):877-82.
[13] Interleukin-6 in aging and chronic disease: a magnificent pathway. Maggio M, Guralnik JM, Longo DL, Ferrucci L J Gerontol A Biol Sci Med Sci. 2006 Jun; 61(6):575-84
[14] Custodero C, Mankowski RT, Lee SA, et al. Evidence-based nutritional and pharmacological interventions targeting chronic low-grade inflammation in middle-age and older adults: A systematic review and meta-analysis. Ageing Res Rev. 2018;46:42-59. doi:10.1016/j.arr.2018.05.004
[15] Effects of telmisartan therapy on interleukin-6 and tumor necrosis factor-alpha levels: a meta-analysis of randomized controlled trials. Takagi H, Mizuno Y, Yamamoto H, Goto SN, Umemoto T, All-Literature Investigation of Cardiovascular Evidence Group. Hypertens Res. 2013 Apr; 36(4):368-73.
[16] Kirkland J.L., Tchkonia T., Zhu Y., Niedernhofer L.J., Robbins P.D. The clinical potential of senolytic drugs. J Am Geriatr Soc. 2017;65(10):2297–2301.
[17] Chang J., Wang Y., Shao L., Laberge R.M., Demaria M., Campisi J. Clearance of senescent cells by ABT263 rejuvenates aged hematopoietic stem cells in mice. Nat Med. 2016;22(1):78–83.
[18] Yousefzadeh MJ, Zhu Y, McGowan SJ, et al. Fisetin is a senotherapeutic that extends health and lifespan. EBioMedicine. 2018;36:18-28. doi:10.1016/j.ebiom.2018.09.015
[19] Dietary intake and major food sources of polyphenols in Finnish adults.Ovaskainen ML, Törrönen R, Koponen JM, Sinkko H, Hellström J, Reinivuo H, Mattila P J Nutr. 2008 Mar; 138(3):562-6.
[20] Jane Higdon, Drake VJ. An evidence-based approach to phytochemicals and other dietary factors. 2. Chapter 8–19 New York: Thieme; 2013.
[21] Si H, Liu D. Dietary antiaging phytochemicals and mechanisms associated with prolonged survival. J Nutr Biochem. 2014;25(6):581-591. doi:10.1016/j.jnutbio.2014.02.001
[22] Estimation of scavenging activity of phenolic compounds using the ABTS(*+) assay. Nenadis N, Wang LF, Tsimidou M, Zhang HY J Agric Food Chem. 2004 Jul 28; 52(15):4669-74.
[23] Decline in transcriptional activity of Nrf2 causes age-related loss of glutathione synthesis, which is reversible with lipoic acid.Suh JH, Shenvi SV, Dixon BM, Liu H, Jaiswal AK, Liu RM, Hagen TM Proc Natl Acad Sci U S A. 2004 Mar 9; 101(10):3381-6.
[24] Dietary epicatechin promotes survival of obese diabetic mice and Drosophila melanogaster. Si H, Fu Z, Babu PV, Zhen W, Leroith T, Meaney MP, Voelker KA, Jia Z, Grange RW, Liu D J Nutr. 2011 Jun; 141(6):1095-100.
[25] Curcumin-supplemented diets increase superoxide dismutase activity and mean lifespan in Drosophila.Shen LR, Xiao F, Yuan P, Chen Y, Gao QK, Parnell LD, Meydani M, Ordovas JM, Li D, Lai CQ Age (Dordr). 2013 Aug; 35(4):1133-42.
[26] Resveratrol protects spinal cord dorsal column from hypoxic injury by activating Nrf-2.Kesherwani V, Atif F, Yousuf S, Agrawal SK Neuroscience. 2013 Jun 25; 241():80-8.
[27] Effects of quercetin and fish n-3 fatty acids on testicular injury induced by ethanol in rats. Uygur R, Yagmurca M, Alkoc OA, Genc A, Songur A, Ucok K, Ozen OA Andrologia. 2014 May; 46(4):356-69.
[28] Molecular mechanisms activating the Nrf2-Keap1 pathway of antioxidant gene regulation. Kobayashi M, Yamamoto M Antioxid Redox Signal. 2005 Mar-Apr; 7(3-4):385-94.
[29] Si H, Liu D. Dietary antiaging phytochemicals and mechanisms associated with prolonged survival. J Nutr Biochem. 2014;25(6):581-591. doi:10.1016/j.jnutbio.2014.02.001
[30] Resveratrol and health–a comprehensive review of human clinical trials.Smoliga JM, Baur JA, Hausenblas HA Mol Nutr Food Res. 2011 Aug; 55(8):1129-41.
[31] Dietary resveratrol prevents Alzheimer’s markers and increases life span in SAMP8. Porquet D, Casadesús G, Bayod S, Vicente A, Canudas AM, Vilaplana J, Pelegrí C, Sanfeliu C, Camins A, Pallàs M, del Valle J
Age (Dordr). 2013 Oct; 35(5):1851-65.
[32] Resveratrol prolongs lifespan and retards the onset of age-related markers in a short-lived vertebrate.Valenzano DR, Terzibasi E, Genade T, Cattaneo A, Domenici L, Cellerino A Curr Biol. 2006 Feb 7; 16(3):296-300.
[33] Resveratrol delays age-related deterioration and mimics transcriptional aspects of dietary restriction without extending life span. Pearson KJ, Baur JA, Lewis KN, Peshkin L, Price NL, Labinskyy N, Swindell WR, Kamara D, Minor RK, Perez E, Jamieson HA, Zhang Y, Dunn SR, Sharma K, Pleshko N, Woollett LA, Csiszar A, Ikeno Y, Le Couteur D, Elliott PJ, Becker KG, Navas P, Ingram DK, Wolf NS, Ungvari Z, Sinclair DA, de Cabo R Cell Metab. 2008 Aug; 8(2):157-68.
[34] SIRT1 is required for AMPK activation and the beneficial effects of resveratrol on mitochondrial function. Price NL, Gomes AP, Ling AJ, Duarte FV, Martin-Montalvo A, North BJ, Agarwal B, Ye L, Ramadori G, Teodoro JS, Hubbard BP, Varela AT, Davis JG, Varamini B, Hafner A, Moaddel R, Rolo AP, Coppari R, Palmeira CM, de Cabo R, Baur JA, Sinclair DA Cell Metab. 2012 May 2; 15(5):675-90.
[35] Chocolate and prevention of cardiovascular disease: a systematic review.
Ding EL, Hutfless SM, Ding X, Girotra S
Nutr Metab (Lond). 2006 Jan 3; 3():2.
[36] Vascular effects of cocoa rich in flavan-3-ols.Heiss C, Dejam A, Kleinbongard P, Schewe T, Sies H, Kelm M JAMA. 2003 Aug 27; 290(8):1030-1.
[37] Dietary epicatechin promotes survival of obese diabetic mice and Drosophila melanogaster.Si H, Fu Z, Babu PV, Zhen W, Leroith T, Meaney MP, Voelker KA, Jia Z, Grange RW, Liu DJ Nutr. 2011 Jun; 141(6):1095-100.
[38] Significant longevity-extending effects of EGCG on Caenorhabditis elegans under stress. Zhang L, Jie G, Zhang J, Zhao B Free Radic Biol Med. 2009 Feb 1; 46(3):414-21.
[39] Mortality among female practitioners of Chanoyu (Japanese “tea-ceremony”).Sadakata S, Fukao A, Hisamichi S Tohoku J Exp Med. 1992 Apr; 166(4):475-7.
[40] Curcumin-supplemented diets increase superoxide dismutase activity and mean lifespan in Drosophila. Shen LR, Xiao F, Yuan P, Chen Y, Gao QK, Parnell LD, Meydani M, Ordovas JM, Li D, Lai CQ Age (Dordr). 2013 Aug; 35(4):1133-42.
[41]Intracellular ROS protection efficiency and free radical-scavenging activity of curcumin. Barzegar A, Moosavi-Movahedi AA PLoS One. 2011; 6(10):e26012.
[42] Hendler SS. PDR for Nutritional Supplements. 2nd. Thomson Reuters; 2008.
[43] Maher P. How fisetin reduces the impact of age and disease on CNS function. Front Biosci (Schol Ed) 2015;7:58–82.
[44] Kimira M., Arai Y., Shimoi K., Watanabe S. Japanese intake of flavonoids and isoflavonoids from foods. J Epidemiol. 1998;8(3):168–175.
[45] Zhu Y., Doornebal E.J., Pirtskhalava T., Giorgadze N., Wentworth M., Fuhrmann-Stroissnigg H. New agents that target senescent cells: the flavone, fisetin, and the BCL-XL inhibitors, A1331852 and A1155463. Aging (Albany NY). 2017;9(3):955–963.
[46] Gurau F., Baldoni S., Prattichizzo F., Espinosa E., Amenta F., Procopio A.D. Anti-senescence compounds: a potential nutraceutical approach to healthy aging. Ageing Res Rev. 2018;46:14–31.
[47] Gupta S.C., Tyagi A.K., Deshmukh-Taskar P., Hinojosa M., Prasad S., Aggarwal B.B. Downregulation of tumor necrosis factor and other proinflammatory biomarkers by polyphenols. Arch Biochem Biophys. 2014;559:91–99.
[48] Noninvasive quantification of ascorbate and glutathione concentration in the elderly human brain.Emir UE, Raatz S, McPherson S, Hodges JS, Torkelson C, Tawfik P, White T, Terpstra M NMR Biomed. 2011 Aug; 24(7):888-94.
[49] Concurrent regulation of the transcription factors Nrf2 and ATF4 mediates the enhancement of glutathione levels by the flavonoid fisetin.Ehren JL, Maher P Biochem Pharmacol. 2013 Jun 15; 85(12):1816-26.
[50] The flavonoid fisetin promotes nerve cell survival from trophic factor withdrawal by enhancement of proteasome activity. Maher P Arch Biochem Biophys. 2008 Aug 15; 476(2):139-44.