La jeunesse, c’est la facilité à se fournir en énergie et à se débarrasser de ses déchets
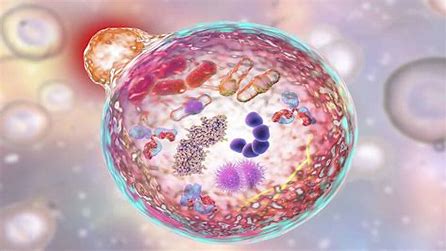
L’autophagie est un processus cellulaire catabolique non spécifique conservé au cours de l’évolution, qui facilite le recyclage des protéines et des organites intra-cellulaires altérées[1]. Elle peut s’appliquer également à la destruction des bactéries et des virus (xénophagie), aux mitochondries (mitophagie), aux agrégats protéiques (aggrephagie) et au métabolisme lipidique (lipophagie). L’autophagie est une réponse au stress cellulaire d’origines diverses, qui permet de réguler la production d’énergie et le contrôle qualité des organites intra-cellulaires.

La restriction calorique augmente l’activité autophagique, qui correspond à une activité autolytique, stimulée en situation de jeûne. L’autophagie remplit ici sa double fonction de fourniture d’énergie en situation de privation calorique et de maintenance cellulaire, en éliminant les composants défectueux.
L’autophagie, qui intervient dans la régulation de la fourniture d’énergie en fonction des besoins énergétiques de l’organisme répond aux hormones qui régulent le taux de glucose dans les cellules: l’insuline est sécrétée quand un repas riche en glucose (sucre) permet à l’organisme de reconstituer ses réserves intra-cellulaires. Elle fait entrer le glucose dans les cellules et inhibe l’autophagie qui n’est plus nécessaire, tandis que le glucagon qui prend le dessus en situation de dépense énergétique élevée ou de privation calorique, favorise la circulation plasmatique du glucose de réserve, et stimule l’autophagie afin d’apporter un complément de ressource énergétique.
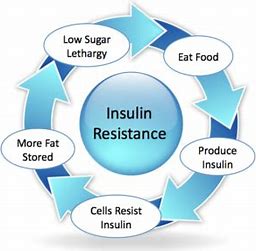
Le développement d’une résistance progressive à l’insuline, typique des cellules vieillissantes[2], provoque une activation constante des récepteurs à insuline. L’excès d’insuline circulante entraîne une inhibition chronique de l’autophagie, qui conduit à un ralentissement de la cadence dans l’élimination des vacuoles autophagiques. Ces altérations cellulaires aboutissent inévitablement au déclin progressif de la fonction, particulièrement des cellules à durée de vie longue, comme les neurones, les cellules cardiaques et les fibres musculaires squelettiques. Le déclin de l’adaptabilité de l’organisme âgé, qui se caractérise par sa fragilité, sa difficulté à se réparer, le conduit au décès[3].
L’autophagie s’interface également avec les dispositifs de régulation de l’immunité et de l’inflammation sur un mode réciproque. Les protéines de l’autophagie interviennent sur l’activation et la suppression des réponses immunitaires et inflammatoires, tandis que les signaux inflammatoires et immunitaires peuvent déclencher ou stopper l’autophagie[4]. L’autophagie joue un rôle important dans la résistance aux infections bactériennes chez les plantes et les animaux, y compris chez l’homme[5]. Son altération au fil du temps est intimement liée au déclin de la réponse immunitaire et de la résistance aux infections au cours du vieillissement.

De nombreuses études ont montré que l’augmentation de la capacité autophagique pouvait augmenter l’espérance de vie et réduire les pathologies liées au vieillissement[6].
Pour en savoir plus, notre ouvrage sur l’avenir du vieillissement: “Vieillir, un destin remédiable“.
[1] Levine B, Mizushima N, Virgin HW. Autophagy in immunity and inflammation. Nature. 2011;469(7330):323–335.
[2] Donati A, et al. Age-related changes in the regulation of autophagic proteolysis in rat isolated hepatocytes. J. Gerontol. A Biol. Sci. Med. Sci. 2001;56:B288–B293.
[3] Terman A, Kurz T, Navratil M, Arriaga EA, Brunk UT. Mitochondrial turnover and aging of long-lived postmitotic cells: the mitochondrial-lysosomal axis theory of aging. Antioxid Redox Signal. 2010;12(4):503-535. doi:10.1089/ars.2009.2598
[4] Levine B, Kroemer G. Autophagy in the pathogenesis of disease. Cell. 2008;132:27–42.
[5] Kumar D, et al. Genome-wide analysis of the host intracellular network that regulates survival of Mycobacterium tuberculosis. Cell. 2010;140:731–743.
[6] Harrison DE, Strong R, Sharp ZD, Nelson JF, Astle CM, Flurkey K, Nadon NL, Wilkinson JE, Frenkel K, Carter CS, Pahor M, Javors MA, Fernandez E, Miller RA. Rapamycin fed late in life extends lifespan in genetically heterogeneous mice. Nature. 2009;460:392–395.