Temps de lecture estimé : 40 mn
“The rush of battle is often a potent and lethal addiction, for war is a drug” Chris Hedges (2002) (38)

« L’addiction est un processus dans lequel est réalisé un comportement qui peut avoir pour fonction de procurer du plaisir et/ou de soulager un malaise intérieur et qui se caractérise par l’échec répété de son contrôle et sa persistance en dépit de la connaissance de ses conséquences négatives »[1]. La dépendance psychologique, ou addiction (nous emploierons les deux termes), se traduit ainsi par la recherche compulsive du produit ou du comportement (craving), et l’impossibilité de contrôler ou de stopper la consommation ou le comportement malgré la volonté de le faire.
La décision n’est pas le libre arbitre
La décision chez l’individu en bonne santé relève de deux mécanismes complémentaires : un mécanisme planifié, dépendant d’une évaluation préalable des conséquences d’un choix, de son utilité, mécanisme lent mais contrôlé consciemment, déclaratif ; et un mécanisme automatisé, rapide et peu flexible, généralement mis en place à l’issue d’une procédure d’apprentissage , qui consolide des choix comportementaux itératifs, comme jouer du violon, conduire une voiture, manger, -ce qui libère l’attention pour d’autres choix planifiés intercurrents.
Le système planifié déclaratif siège dans le cortex entorhinal, prélimbique, orbitofrontal, le striatum ventral et l’hippocampe.
Le système automatique procédural dépend d’une boucle entre le cortex pariétal, infra-limbique et le striatum dorsal.
Ces deux systèmes reçoivent des afférences dopaminergiques modulatrices issues de l’aire tegmentale ventrale pour le système planifié et de la substance noire pour le système automatique.
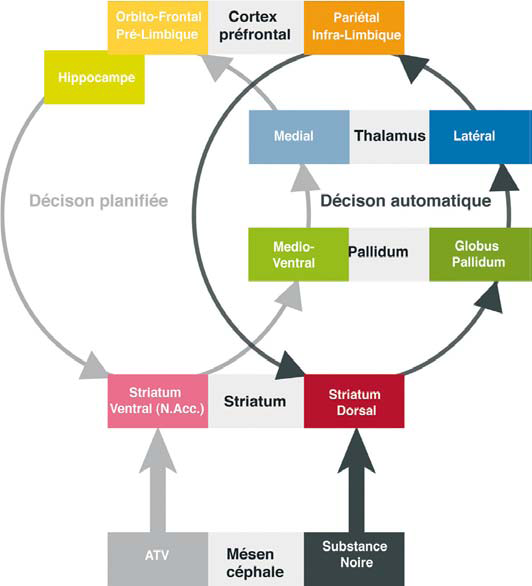
Le système de prise de décision planifiée implique une boucle neuronale striato-pallido-thalamo-corticale, médio-ventrale (gris clair), régulée par les projections dopaminergiques issues de l’aire tegmentale ventrale (ATV). Les projections dopaminergiques de la substance noire modulent une boucle striato-pallidothalamo- corticale (gris foncé) située latéro-dorsalement à la précédente. Cette boucle sous-tend le système de décision planifié. Les résultats récents des neurosciences suggèrent que l’activation excessive de la boucle médio-ventrale renforcerait la connectivité entre les deux sytèmes. Ce processus se traduirait sur le plan comportemental par une implication croissante du système de décision automatique, au détriment du système de prise de décision planifiée. N.Acc : Nucleus Accumbens remerciemenents à Balland B , Lüscher C. (2009) (1)
La récompense crée des passions
Le système de la récompense est directement impliqué dans ce mécanisme d’apprentissage et de décision. Il trouve son origine dans une petite structure localisée au sommet du tronc cérébral, l’aire tegmentale ventrale (VTA). Cette dernière est directement connectée avec le cortex préfrontal et le noyau accumbens, mais aussi avec l’amygdale et l’hippocampe. La transmission de l’information entre la VTA et ses structures cibles fait intervenir la dopamine.
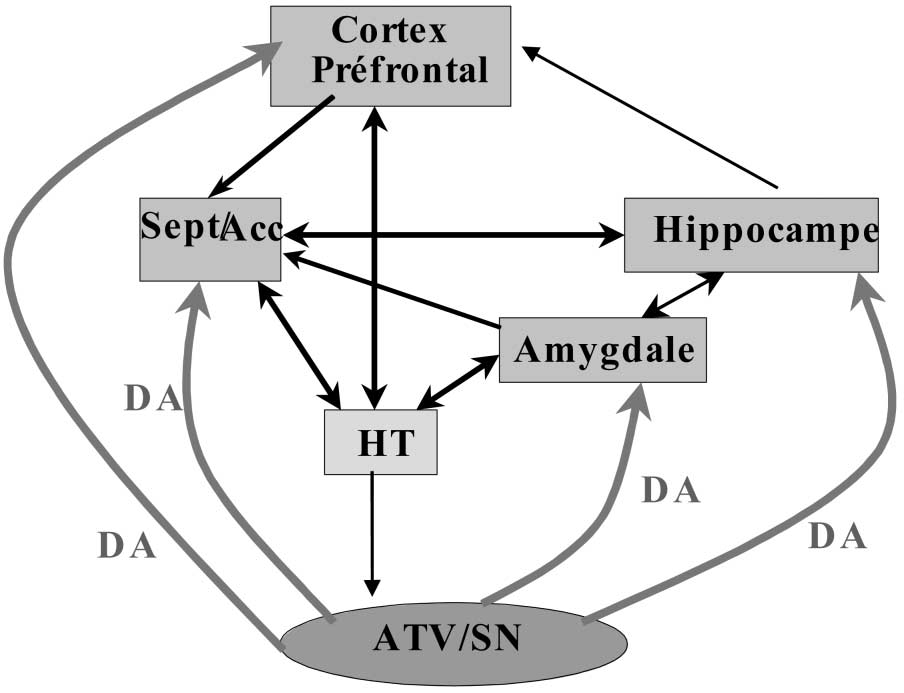
Le circuit cérébral de la récompense Ce circuit peut être considéré comme constitué de plusieurs structures corticales et sous-corticales (en orange) qui sont reliées entre elles par des cellules effectrices . Les neurones dopaminergiques, modulateurs (en rouge), innervent toutes ces structures de façon divergente à partir de l’aire tegmentale ventrale (ATV) et la substance noire (SN). L’ensemble des informations traitées par les neurones du circuit de la récompense converge vers l’hypothalamus (en vert) qui lui-même interagit avec les neurones dopaminergiques du mésencéphale (ATV/SN). Il est à noter qu’aucune information issue de l’environnement extérieur n’atteint l’hypothalamus sans avoir été préalablement traitée par une au moins des structures qui constituent le circuit de la récompense. DA = dopamine, Sep/Acc = septum / noyau accumbens, double flèche = interaction entre système effecteur et système modulateur.
La dopamine intervient donc dans l’apprentissage de comportements orientés vers la recherche de récompense. Elle instruit le système de décision d’une relation entre une situation donnée et l’obtention d’une récompense, d’un plaisir. Les neurones de la VTA codent la différence entre ce qui est attendu et ce qui est obtenu. La récompense est systématiquement comparée avec la prédiction, et la différence constitue ce que l’on appelle « l’erreur de prédiction de la récompense ». Lorsque le lien s’est construit entre le comportement et l’effet recherché, que l’apprentissage est terminé, la stimulation dopaminergique cesse habituellement.
Diana Martinez a montré une relation entre la concentration de récepteurs à dopamine et le statut social : « cette molécule […] met en œuvre des circuits de neurones impliqués dans la motivation », « le statut social est évidemment une source de satisfaction importante puisqu’elle recouvre de multiples plaisirs : pouvoir, argent, relations sexuelles, présence d’un entourage ». « Il semble que les personnes ayant de plus fortes concentrations de récepteurs de la dopamine soient davantage motivées, car elles en retireraient un plaisir intense ».
« À l’inverse, les individus dont le cerveau est pauvre en récepteurs de la dopamine sont plus vulnérables à la consommation de drogues qui stimulent artificiellement les circuits de la dopamine : leurs circuits dopaminergiques sont naturellement trop discrets pour être satisfaits par les réalisations sociales[2] ».
Les stimuli addictifs (substances et comportements) sont perçus comme des récompenses, ce qui renforce leur consommation, mais ils augmentent la sécrétion dopaminergique du striatum ventral, ce qui empêche l’effet d’atténuation normalement observé après la répétition d’un stimulus « récompensant »[3]. Le système de décision planifiée est sans cesse sollicité par la dopamine en direction du stimulus addictif, et le système de décision automatique prend finalement le relais, pour installer une compulsion invincible pour le produit, ou pour le comportement addictif[4].
La plasticité synaptique est le mécanisme d’adaptation neuronale qui est à la base de la formation et de la modification des réseaux neuronaux, « c’est le corrélat cellulaire des mécanismes d’apprentissage ». La synapse est la zone de contact entre deux neurones. La libération de neurotransmetteurs par le neurone d’amont permet leur fixation par les récepteurs du neurone d’aval. En jouant sur l’expression des récepteurs ou la quantité de neurotransmetteurs libérés, les neurones renforcent (potentialisation à long terme ou PLT) ou dépriment (dépression à long terme ou DLT) la transmission synaptique.
Dans le cas de l’addiction, une substance addictive ou un comportement associé à un stress déclenche une PLT au niveau des synapses glutamatergiques établies avec les neurones dopaminergiques de l’ATV par augmentation massive de la concentration de dopamine dans la synapse[5]. Le système décisionnel planifié est d’abord sollicité mais rapidement s’opère une transition en faveur du mode automatique[6], sous l’effet de l’activation persistante et soutenue de l’ATV, par recrutement des afférences dopaminergiques projetant vers le cortex infralimbique et le striatum dorsal, centres de la décision automatique[7]. Ce remodelage massif des réseaux d’apprentissage est sous la dépendance de nombreux facteurs physiologiques et l’analyse génétique a déjà montré l’existence de facteurs de vulnérabilité à l’origine des défaillances des systèmes de décision, assimilés à des « synaptopathies »[8].
Des traits de personnalité ont été repérés par Zuckerman[9] comme facteurs de risques individuels :
- Recherche de sensations
- Faible évitement du danger
- Recherche de nouveautés
- Faible estime de soi
- Réactions émotionnelles excessives
- Difficultés relationnelles
Le stress peut être perçu comme une récompense
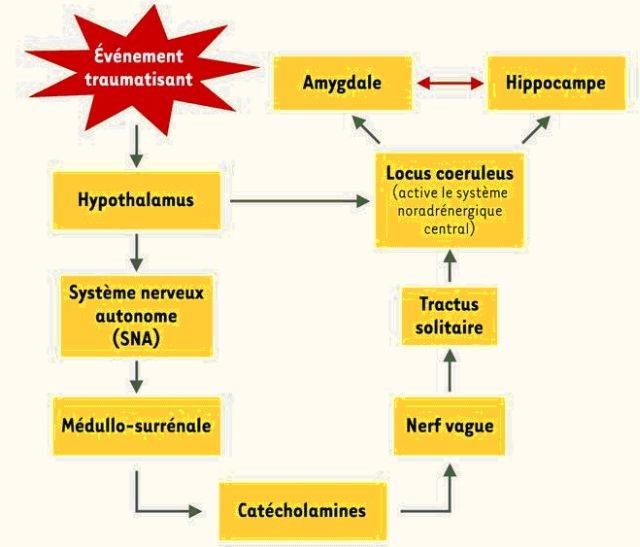
L’addiction spécifique à l’exercice doit être comprise à la lumière de la théorie synaptique de la dépendance psychologique. Le stress induit par l’exercice, en activant la voie hypothalamo-hypophyso-surrénalienne, déclenche une sécrétion de cortisol, qui facilite et amplifie la sécrétion dopaminergique[10],[11]. Celle-ci fait « signe », par le circuit méso-limbique, et force l’interprétation par le cerveau de l’agent stresseur comme étant une source de récompense[12].
Thierry et al[13] ont montré qu’en période de stress, la voie dopaminergique mésocorticale était spécifiquement et fortement sollicitée. L’axe hypothalamo-hypophyso-surrénalien, le cortex préfrontal médian et l’aire tegmentale ventrale forment une boucle dont la fonction est de réguler la production excessive de cortisol en exerçant un contrôle négatif sur l’axe hypothalamo-hypophyso-surrénalien. Il semble que l’amplitude de la réponse dopaminergique mésocorticale soit proportionnelle à l’effort sollicité par le circuit mésocortical en période de stress pour conserver ou rétablir l’homéostasie.
Les mécanismes d’automatisation de la décision prennent progressivement le relais de la décision planifiée[14], chez les personnes sujettes au développement du processus addictif, qui ont la surprise de se découvrir progressivement « accro » aux sorties dures, aux séances extrêmes, dont elles ne retirent pourtant pas de plaisir particulier[15] ! Le seuil de sécrétion basale dopaminergique s’élevant au fur et à mesure que sa production est sollicitée[16], l’agent stresseur doit fournir une « charge inductive » de plus en plus élevée pour produire l’effet de récompense, par augmentation de la sécrétion de dopamine au dessus-du seuil basal.
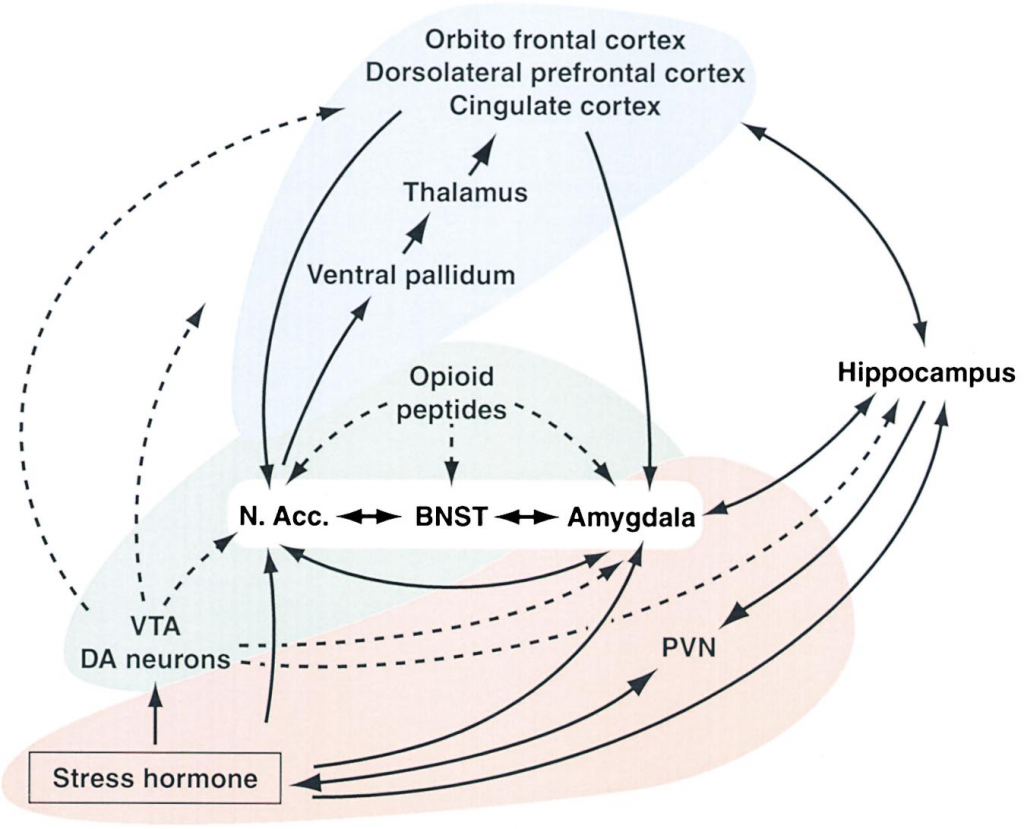
Le manque dans l’addiction est lié à un taux de sécrétion dopaminergique inférieur au seuil basal. Cette hypo sécrétion se produit lorsqu’une récompense anticipée ne se réalise pas, sous l’influence de l’hypothalamus. Ce taux est théoriquement repérable par des techniques neurobiologiques, puisqu’il se traduirait par une baisse globale de libération de dopamine[17]. Pour qu’il y ait satisfaction, ou tout au moins pour que la sensation désagréable d’un besoin disparaisse, le système doit au moins atteindre et éventuellement dépasser le seuil basal. Qui plus est, tout comportement entraînant le système trop au-dessus du seuil aura pour conséquence de l’augmenter, puisqu’il sera pris en compte dans l’évaluation du futur seuil. Par la suite, l’obtention de nouvelles satisfactions nécessitera un effort plus important.
Rôle du stress dans l’adaptation de l’organisme
Le stress en situation réelle (effort physique, infection, danger…) tient lieu de réaction d’alerte, et déclenche des processus d’adaptation immédiate (fly or fight), puis différée à l’agent stresseur. Dans le cas du sport, les adaptations physiologiques à l’exercice peuvent être considérées comme des réponses à la réaction d’alerte. Leur but est de normaliser la réponse du corps vis-à-vis de l’agent stresseur, ce qui aboutit à la cessation de la réaction d’alerte, et à la disparition du stress lui-même. Les sportifs bien entraînés, et d’un niveau de maîtrise élevé, ont ainsi des niveaux de sécrétion de cortisol au repos équivalents aux sédentaires, et à l’effort moins élevés que les sédentaires et les pratiquants peu expérimentés pour un niveau d’effort identique[18].
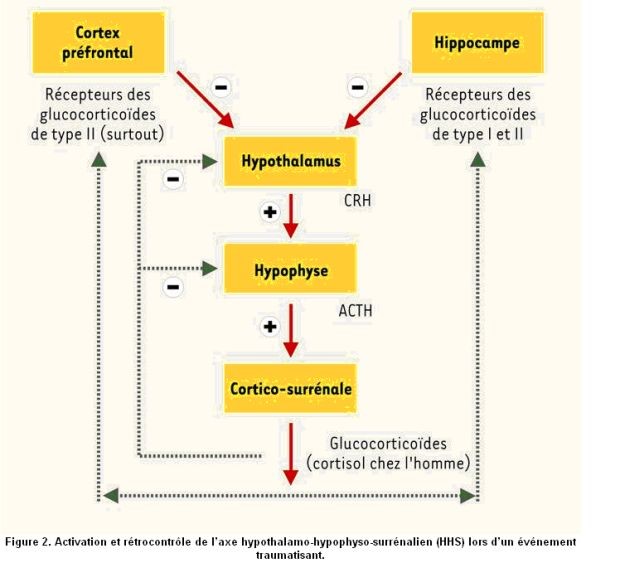
Le cortisol, témoin des contraintes, agent d’adaptation, régulateur comportemental :
– Le cortisol augmente à l’exercice et atteint son taux maximal après 30 à 45 mn et proportionnellement à l’intensité de l’exercice. Le retour à l’état basal en quelques heures et lui-même proportionnel à la durée et l’intensité de l’exercice de 1 à 3 heures.
– L’entraînement diminue le taux basal de cortisol et d’ACTH pour une même puissance d’exercice, mais à puissance relative égale, ces taux ne changent pas . L’entraînement diminue la cortisolémie à l’exercice[19].
– L’entraînement diminue la réponse ACTH-cortisol à l’exercice prolongé, par retardement de l’hypoglycémie, car à taux de glucose égal, la sécrétion de cortisol est inchangée.
– Il participe à l’activation de la lipase qui transforme les TG en AG et glycerol, AG disponibles pour la fourniture énergétique, mais son effet est limité, l’adrénaline et l’hormone de croissance élèvent encore la consommation des AGL.
– Les taux de cortisol basal, rapport cortisol libre/cortisol lié, cycle saisonnier et nycthéméral du cortisol sont identiques au repos chez la femme sédentaire et la sportive entraînée18.
– L’hypercortisolémie pourrait être un simple témoin des contraintes imposées à l’organisme, ou bien un facteur d’adaptation métabolique, ou bien un agent régulateur du comportement par l’intermédiaire du SNC19.
– P.Passelergue et P.Lac[20] ont montré sur 15 semaines d’entraînement que le taux de cortisol salivaire variait en proportion inverse de la progression de la force explosive chez de jeunes lutteurs de haut niveau, ce qui confirme son rôle d’indicateur de charge.
Le stress agit comme un leurre pour les personnes à risque
Chez une minorité de personnes, le stress cesse d’être un stimulus anormal que le corps vise à neutraliser, mais devient au contraire le stimulus recherché pour lui-même, grâce à son influence sur la sécrétion dopaminergique, et sur le seuil basal sécrétoire. L’exercice n’est plus pratiqué dans un objectif de maîtrise, qui annule la réaction de stress, mais c’est l’au-delà de la maîtrise qui est recherché pour son effet stresseur, car c’est l’effet stresseur qui déclenche la sécrétion de dopamine, via les glucocorticoïdes.
Le stress peut être considéré chez certaines personnes présentant un profil génétique[21], des traits de personnalité[22] et une histoire individuelle marquée par des antécédents traumatiques[23], comme un inducteur dopaminergique, stimulant un intérêt pour l’action stressante, par l’effet d’un leurre endocrinien ! Ce comportement contre-productif conduit à instaurer durablement un état de stress dont la pérennisation induit de nombreux effets dommageables pour l’organisme (syndrome métabolique, hypertension, fatigue chronique, dépression…).
La sensibilité initiale particulière de certains sujets ne joue que sur la phase d’amorçage ; en effet, une fois le circuit automatisé mis en place, la volonté, le désir, la raison, n’ont plus de prise sur le comportement de la personne21. Elle subit un mécanisme d’emprise, qui échappe à toute élaboration symbolique, car il est de nature physiologique.
Ce phénomène permet de rendre compte de comportements visant à accroître la dureté des séances d’entraînement, à supporter l’exercice dans des conditions extrêmes de douleurs et de blessures, malgré la conscience du danger à persévérer dans ce contexte. Il rend compte également des comportements de prise de risque croissante, en sport extrême, mais également en situation de jeu d’argent, de jeu virtuel, de combat. Un sentiment d’obligation impérieuse guide les sujets, comme sous l’effet d’une suggestion hypnotique, mais qui s’inscrit dans le « disque dur » du matériel cérébral.
Le mécanisme neuronal sous-jacent au processus addictif éclaire le passage de comportements ordinaires de la vie courante (jeux, sport, sexe, alimentation…) vers un comportement pathologique, selon une dynamique bio-psycho-sociale, qui met en jeu aussi bien les propensions génétiques que les empreintes culturelles.
Bien que rare, la mise en place de ce dispositif doit être mieux comprise afin de prévenir et de traiter plus efficacement les sujets sensibles ou soumis au processus addictif.
De nombreuses études doivent encore rendre compte de la sensibilité particulière de certaines personnes, des profils génétiques, de la relation entre trait de personnalité et caractéristiques neuro-physiologiques, comme le seuil basal de sécrétion dopaminergique. Le rôle du stress doit également donner lieu à des éclaircissements sur l’impact direct du cortisol sur les structures cérébrales, mais aussi sur l’impact des catécholamines, l’impact cérébral des facteurs de l’inflammation produits par l’exercice. Le modèle de l’addiction au stress devrait néanmoins permettre, en tout état de cause, de détecter les profils à risque par leurs traits de personnalité, voire à terme par leur sensibilité biologique, et de guider les entraîneurs dans la reconnaissance sur le terrain les personnes à risque. Sans doute une pédagogie préventive du processus addictif portera-t-elle l’attention du sportif sur les aspects techniques (maîtrise, coordination) et sociaux (convivialité, règles, gestion des conflits), de la pratique, plutôt que de la centrer sur la recherche de sensation et d’émotion, qui sont les vecteurs de valorisation du sport dominants actuellement dans les media, et la voie finale commune du déclenchement du processus addictif.
Questionnaires d’évaluation de la dépendance psychique
Les 6 critères de l’addiction
Goodman (1990)
1/ Echecs répétés de résister à l’impulsion d’entreprendre un comportement spécifique
2/Sentiment de tension augmentant avant de débuter le comportement
3/Sentiment de plaisir ou de soulagement en entreprenant le comportement
4/Sentiment de perte de contrôle pendant la réalisation du comportement
5/Certains symptômes de trouble ont persisté au moins un mois ou sont survenus de manière répétée sur une période prolongée.
6/ Présence d’au moins 5 des 9 conditions suivantes:
Préoccupation fréquente
Intensité et durée plus importantes que souhaitées
Tentatives répétées pour contrôler, réduire ou abandonner
Long délai pour se remettre
Apparition lorsque le sujet doit accomplir des obligations
Activités majeures sacrifiées du fait du comportement
Perpétuation du comportement malgré les conséquences néfastes
Besoin d’augmenter l’intensité ou la fréquence pour obtenir l’effet désiré
Agitation ou irritabilité en cas d’impossibilité de réaliser le comportement
Critères de la dépendance à l’exercice
(D. Veale, 1991) (30)
- Réduction du répertoire des exercices physiques conduisant à une activité physique stéréotypée, pratiquée au moins une fois par jour.
- L’activité physique est plus investie que tout autre.
- Augmentation de la tolérance de l’intensité de l’exercice, d’année en année.
- Symptômes de sevrage avec tristesse lors de l’arrêt (volontaire ou contraint) de l’exercice physique.
- Atténuation ou disparition des symptômes de sevrage à la reprise de l’exercice.
- Perception subjective d’un besoin compulsif d’exercice.
- Réinstallation rapide de l’activité compulsive après une période d’interruption.
- Poursuite de l’exercice physique intense en dépit de maladies physiques graves causées, aggravées ou prolongées par le sport. Négligence des avis contraires donnés par les médecins ou les entraîneurs.
- Difficultés ou conflits avec la famille, les amis ou l’employeur liés à l’activité sportive.
Le sujet s’oblige à perdre du poids en suivant un régime, pour améliorer ses performances.
Running Addiction Scale
(Champan et Castro, 1990)
- Je cours très souvent et régulièrement (+ 1)
- Si le temps est froid, trop chaud, s’il y du vent, je ne cours pas (- 1)
- Je n’annule pas mes activités avec les amis pour courir (- 1)
- J’ai arrêté de courir pendant au moins une semaine pour des raisons autres que des blessures (- 1)
- Je cours même quand j’ai très mal (+ 1)
- Je n’ai jamais dépensé d’argent pour courir, pour acheter des livres sur la course, pour m’équiper (- 1)
- Si je trouvais une autre façon de rester en forme physique je ne courrais pas (- 1)
- Après une course je me sens mieux (+ 1)
- Je continuerais de courir même si j’étais blessé (-1 )
- Certains jours, même si je n’avais pas le temps, je vais courir (+ 1)
J’ai besoin de courir au moins une fois par jour (+ 1)
Critères de dépendance au body-building
(D. Smith, 1998)
- Je m’entraîne même quand je suis malade ou grippé.
- Il m’est arrivé de continuer l’entraînement malgré une blessure.
- Je ne raterais jamais une séance d’entraînement, même si je ne me sens pas en forme.
- Je me sens coupable si je rate une séance d’entraînement.
- Si je rate une séance, j’ai l’impression que ma masse musculaire se réduit.
- Ma famille et/ou mes amis se plaignent du temps que je passe à l’entraînement.
- Le body-building a complètement changé mon style de vie.
- J’organise mes activités professionnelles en fonction de mon entraînement.
Si je dois choisir entre m’entraîner et travailler, je choisis toujours l’entraînement.
Dr Claire Condemine-Piron Présentation de l’auteur
En savoir plus sur l‘Institut d’Hygiologie
Références
1.Balland B , Lüscher C. (2009)
Addiction: from learning to compulsion.
Psychiatr Sci Hum Neurosci (2009) 7:35-42
2. Belin D, Everitt BJ (2008) Cocaine seeking habits depend upon
dopamine-dependent serial connectivity linking the ventral with
the dorsal striatum. Neuron 57:432–441
3. Bellone C, Lüscher C (2006) Cocaine triggered AMPA receptor
redistribution is reversed in vivo by mGluR-dependent long-term
depression. Nat Neurosci 9:636–641
4. Berridge KC, Robinson TE (1998) What is the role of dopamine in
reward: hedonic impact, reward learning, or incentive salience?
Brain Res Brain Res Rev 28:309–369
5. Carr DB, Kalivas PW (2008) Confused about NMDA and
addiction? Targeted knockouts provide answers and new questions.
Neuron 59:353–355
6. Engblom D, Bilbao A, Sanchis-Segura C, et al (2008) Glutamate
receptors on dopamine neurons control the persistence of cocaine
seeking. Neuron 59:497–508
7. Everitt BJ, Belin D, Economidou D, et al (2008) Review. Neural
mechanisms underlying the vulnerability to develop compulsive
drug-seeking habits and addiction. Philos Trans R Soc Lond B
Biol Sci 363:3125–3135
8. Goldman D, Oroszi G, Ducci F (2005) The genetics of addictions:
uncovering the genes. Nat Rev Genet 6:521–532
9. Hyman SE, Malenka RC, Nestler EJ (2006) Neural mechanisms of
addiction: the role of reward-related learning and memory. Annu
Rev Neurosci 29:565–598
10. Koob GF (2008) A role for brain stress systems in addiction.
Neuron 59:11–34
11. Kreek M, Nielsen DA, Butelman ER, LaForge KS (2005) Genetic
influences on impulsivity, risk taking, stress responsivity and
vulnerability to drug abuse and addiction. Nat Neurosci 8:1450–1457
12. Lüscher C, Bellone C (2008) Cocaine-evoked synaptic plasticity:
a key to addiction? Nat Neurosci 11:737–738
13. Lüscher C, Ungless MA (2006) The mechanistic classification of
addictive drugs. PLoS Med 3:e437
14. Mameli M, Balland B, Lujàn R, Lüscher C (2007) Rapid synthesis
and synaptic insertion of GluR2 for mGluR-LTD in the ventral
tegmental area. Science 317:530–533
15. Genève/Brasilia OMS (2004) Neuroscience of psychoactive
substance use and dependence. ISBN: 92 4 259124 6
16. Pessiglione M, Seymour B, Flandin G, et al (2006) Dopaminedependent
prediction errors underpin reward-seeking behaviour in
humans. Nature 442:1042–1045
17. Redish AD, Jensen S, Johnson A (2008) A unified framework for
addiction: vulnerabilities in the decision process. Behav Brain Sci
31:415–437 (Discussion 437–487)
18. Saal D, Dong Y, Bonci A, Malenka RC (2003) Drugs of abuse
and stress trigger a common synaptic adaptation in dopamine
neurons. Neuron 37:577–582
19. Schultz W (1998) Predictive reward signal of dopamine neurons.
J Neurophysiol 80:1–27
20. Schultz W, Dickinson A (2000) Neuronal coding of prediction
errors. Annu Rev Neurosci 23:473–500
21. Stipanovich A, Valjent E, Matamales M, et al (2008) A
phosphatase cascade by which rewarding stimuli control nucleosomal
response. Nature 453:879–884
22. Ungless MA, Whistler JL, Malenka RC, Bonci A (2001) Single
cocaine exposure in vivo induces long-term potentiation in
dopamine neurons. Nature 411:583–587
23. Waelti P, Dickinson A, SchultzW(2001) Dopamine responses comply
with basic assumptions of formal learning theory. Nature 412:43–48
24. Zullino DLC (2008) Addiction : le côté obscur de l’apprentissage.
Conférence Jeantet : Genève
25. Piazza P.V. et al., Brain Res., 658 , 259, 1994
26. Millette Caroline, Mémoire de pharmacologie : http://hdl.handle.net/1866/3130).
27.Tronche F. ).Nature Neuroscience, vol. 12, n° 3, mars 2009, pp. 247-249
28.Vidal P.P. Stress, corticoïdes et autoadministration de substances psychoactives Science & Sports Volume 20, Issue 4, August 2005, Pages 226-228
29. Zuckerman M. Cambridge University Press, 1994 ; Ades J., Lejoyeux M. Masson, 1997 ; Masse LC. Arch Gen Psychiatry, 1997.
30. Velea D. In L’addiction à l’exercice physique in : Conduite Dopante, Psychotropes, 2002, 8 (3-4) :39-47
31. Di Chiara G. et Imperato A., Proc. Natl. Acad. Sci. USA, 85 , 5274, 1988.
32. Tilson H.A., Reich R.A., Pharmacol. Biochem. Behav., 1 , 149, 1973
33. Vezina P., Stewart J., Brain Res., 516 , 99, 1991
34. Swan GE, Jack LM, Ward MM. Subgroups of smokers with different success rates after use of transdermal nicotine. Addiction, 92:207-218, 1997
35. DEMINIERE JM, PIAZZA PV, GUEGAN G, ABROUS N, MACCARI S, et coll. Increased locomotor response to novelty and propensity to intravenous amphetamine selfadministration in adult offspring of stressed mothers. Brain Res 1992, 586: 135-139
36 KOEHL M, BJIJOU Y, LE MOAL M, CADOR M. Nicotine-induced locomotor activity is increased by preexposure of rats to prenatal stress. Brain Res 2000, 882 : 196-200
37. Pr Olivier Cottencin http://medecine.univ-lille2.fr/pedagogie/contenu/discipl/sciences_hs/addiction_generalites.pdf
38. Hedges C. War is a force that gives us meaning 2002
39. Van Praag H.M. Clinical and Experimental Psychiatry. Monograph No. 7. 304 pp. New York, Brunner/ Mazel, 1993
40.Goodman A. Addiction, definition and implications British Journal of Addiction Volume 85 Issue 11, Pages 1403 – 1408, 1990
41. Monod H.,Vandewalle H., Flandrois R. – PHYSIOLOGIE DU SPORT. BASES PHYSIOLOGIQUES DES ACTIVITÉS PHYSIQUES ET SPORTIVES, 2007 – Health & Fitness, 6ème édition, – 303 pages
42. PASSELERGUE P., LAC G.Variations du cortisol salivaire au cours de 15 semaines d’entraînement mixte aérobie et anaérobie chez des lutteurs juniors de haut niveau : corrélations avec les Science & sports ISSN 0765-1597 CODEN SCSPED Congrès Colloque Biologique de l’exercice musculaire de la Société de physiologie No6, Clermont-Ferrand , FRANCE (31/05/2007) 2007, vol. 22, no6, pp. 312-314 [3 page(s) (article)] (3 ref.)
43. Duclos M. in Médecine du sport 2006, Brunet Guedj E., 7ème édition 2006, Masson
44.Maheu FS, Lupien SJ. La mémoire aux prises avec les émotions et le stress : un impact nécessairement dommageable ? Médecine/Sciences 2003 ; 19 (1), 118-24
45. Martinez D., Orlowska D., Narendran R., Slifstein M., Liu F., Kumar D., Brof A.t A., Van Heertum R., and Kleber H. D., “Dopamine Type 2/3 Receptor Availability in the Striatum and Social Status in Human Volunteers” by Diana Martinez, in Biological Psychiatry, Volume 67, Issue 3 (February 1, 2010).
46. Thierry AM, Tassin JP,
Blanc G. et al. The effects of
aging on the stress-induced
increases of dopamine and the dopamine … Nature (1976)
263, 242-244.
[1] Goodman A. Addiction, definition and implications British Journal of Addiction Volume 85 Issue 11, Pages 1403 – 1408, 1990
[2] Martinez D., Orlowska D., Narendran R., Slifstein M., Liu F., Kumar D., Brof A.t A., Van Heertum R., and Kleber H. D., “Dopamine Type 2/3 Receptor Availability in the Striatum and Social Status in Human Volunteers” by Diana Martinez, in Biological Psychiatry, Volume 67, Issue 3 (February 1, 2010).
[3] Schultz W, Dickinson A (2000) Neuronal coding of prediction errors. Annu Rev Neurosci 23:473–500
[4] Waelti P, Dickinson A, SchultzW(2001) Dopamine responses comply with basic assumptions of formal learning theory. Nature 412:43–48
[5] Ungless MA, Whistler JL, Malenka RC, Bonci A (2001) Single cocaine exposure in vivo induces long-term potentiation indopamine neurons. Nature 411:583–587
[6] Everitt BJ, Belin D, Economidou D, et al (2008) Review. Neural mechanisms underlying the vulnerability to develop compulsivedrug-seeking habits and addiction. Philos Trans R Soc Lond BBiol Sci 363:3125–3135
[7] Lüscher C, Bellone C (2008) Cocaine-evoked synaptic plasticity: a key to addiction? Nat Neurosci 11:737–738
[8] Balland B , Lüscher C. (2009) Addiction: from learning to compulsion. Psychiatr Sci Hum Neurosci (2009) 7:35-42
[9] Zuckerman M. Cambridge University Press, 1994 ; Ades J., Lejoyeux M. Masson, 1997 ; Masse LC. Arch Gen Psychiatry, 1997.
[10] Piazza P.V. et al., Brain Res., 658 , 259, 1994
[11] Tronche F. ).Nature Neuroscience, vol. 12, n° 3, mars 2009, pp. 247-249
[12] Di Chiara G. et Imperato A., Proc. Natl. Acad. Sci. USA, 85 , 5274, 1988.
[13] Thierry AM, Tassin JP, Blanc G. et al. The effects of aging on the stress-induced increases of dopamine and the dopamine … Nature (1976) 263, 242-244.
[14] Everitt BJ, Belin D, Economidou D, et al (2008) Review. Neural mechanisms underlying the vulnerability to develop compulsivedrug-seeking habits and addiction. Philos Trans R Soc Lond BBiol Sci 363:3125–3135
[15] Vezina P., Stewart J., Brain Res., 516 , 99, 1991
[16] Pr Olivier Cottencin http://medecine.univ-lille2.fr/pedagogie/contenu/discipl/sciences_hs/addiction_generalites.pdf
[17] Balland B , Lüscher C. (2009) Addiction: from learning to compulsion. Psychiatr Sci Hum Neurosci (2009) 7:35-42
[18] Duclos M. in Médecine du sport 2006, Brunet Guedj E., 7ème édition 2006, Masson
[19] Monod H.,Vandewalle H., Flandrois R. – PHYSIOLOGIE DU SPORT. BASES PHYSIOLOGIQUES DES ACTIVITÉS PHYSIQUES ET SPORTIVES, 2007 – Health & Fitness, 6ème édition, – 303 pages
[20] PASSELERGUE P., LAC G.Variations du cortisol salivaire au cours de 15 semaines d’entraînement mixte aérobie et anaérobie chez des lutteurs juniors de haut niveau : corrélations avec les Science & sports ISSN 0765-1597 CODEN SCSPED Congrès Colloque Biologique de l’exercice musculaire de la Société de physiologie No6, Clermont-Ferrand , FRANCE (31/05/2007) 2007, vol. 22, no6, pp. 312-314 [3 page(s) (article)] (3 ref.)
[21] Balland B , Lüscher C. (2009) Addiction: from learning to compulsion. Psychiatr Sci Hum Neurosci (2009) 7:35-42
[22] Zuckerman M. Cambridge University Press, 1994 ; Ades J., Lejoyeux M. Masson, 1997 ; Masse LC. Arch Gen Psychiatry, 1997.
[23] Kreek M, Nielsen DA, Butelman ER, LaForge KS (2005) Genetic influences on impulsivity, risk taking, stress responsivity and vulnerability to drug abuse and addiction. Nat Neurosci 8:1450–1457